
本文闡述了冷凍光學顯微鏡圖像的計算清除技術如何能夠改善冷凍電子顯微鏡對細胞靶區的識別。人類已知的疾病很多。為了找到有效的治療方式,必須對健康和不健康人體當中最基本的細胞機制予以深入研究。冷凍電子顯微鏡工作流程的最新進展使得人們能夠以低于1nm的分辨率來獲取細胞蛋白質社會學的3D數據。為提高該工作流程在生成所需數據時的可靠性,冷凍光學顯微鏡就成為了一個極其重要的工具,可檢查樣本質量,并在冷凍電子顯微鏡內對靶區部位進行常規識別,尤其是針對冷凍斷層成像技術而言,冷凍光學顯微鏡尤為重要。我們在此描述了冷凍光學顯微鏡的圖像質量如何獲得改善,以確保對靶區部位更為精準的識別。
冷凍電子斷層成像工作流程以及冷凍光學顯微鏡的重要性原因說明
許多有關人體生理學和病理學的科學問題只能通過研究最基本的細胞機制才能獲得解答。這些細胞機制是所有功能性組織、器官及整個有機體的根基。
為了解健康和病理生理學狀態下不同細胞類型的功能發揮,因此很有必要確定參與功能實現的生物分子如蛋白質等,同時深入檢查分子水平上的相互作用。
為實現這一點,研究中使用了冷凍透射電子顯微鏡技術(Cryo TEM),并以低于1 nm的超高分辨率在細胞環境內分辨出生物分子。這種方式之下,單獨的蛋白質無需標示就可獲得識別,“只需"通過外形就能辨識。此外,即便在細胞質內有不同的構造和分布也能加以區分。
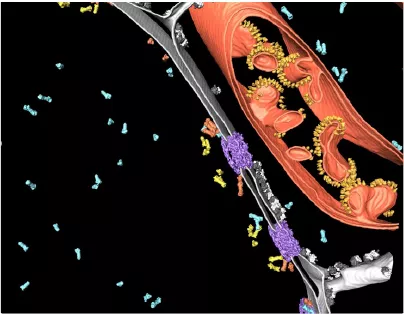
圖1:冷凍電子斷層成像的部分區域,顯示出細胞核周圍的原生細胞環境。蛋白酶體在兩個不同的位置與核孔復合物(紫色)相連(橙色:膜栓系蛋白酶體,黃色:籃狀栓系蛋白酶體,藍色:游離蛋白酶體)。另外還顯示出了細胞核包膜(灰色)、核糖體(黑/白)和線粒體(紅色,有一排黃色的ATP合成酶)。感謝德國馬丁雷德Max Planck生化研究所分子結構生物學系B. Engel博士提供的圖片。原圖發表出處:Albert S, Scha?er M, Beck F, Mosalaganti S, Asano S, Thomas HF, Plitzko JM, Beck M, Baumeister W, Engel BD, Proteasomes tether to two distinct sites at the nuclear pore complex, PNAS, December 2017。
作為先決條件,樣本必須使用復雜精密的技術(玻璃化處理)來進行冷凍固定以避免破壞性的冰晶形成。與其他固定技術不同,蛋白質要盡可能維持接近于其原生狀態。此后,薄樣本(小于300nm)即可在Cryo TEM下進行直接的評估。通過傾斜樣本可創建形成觀察樣本容積的三維數據集并進行重建,從而獲得感興趣蛋白質的3D分布情況(圖2,冷凍電子斷層成像)。

圖2:冷凍電子斷層成像技術的示意圖。使用電子束(TEM)對樣本進行觀察的同時,將樣本傾斜以便從不同的觀察角度創建一系列圖像。3D立體結構得到重建,同時可對蛋白質的分布進行可視化觀察和分析。
為了對樣本“更厚"部分進行觀察,必須將樣本減薄。除了冷凍超薄切片技術外,使用專門的冷凍掃描電子顯微鏡來進行聚焦離子束(FIB)研磨也是一種可選的方法。兩個離子束窗口的定位應確保在感興趣區域內形成厚度大約200 nm的薄冰片(薄層)。通過這種方式,即便是無法深入研究的樣本,也能部分接受Cryo ET的觀察(圖3,FIB研磨)。
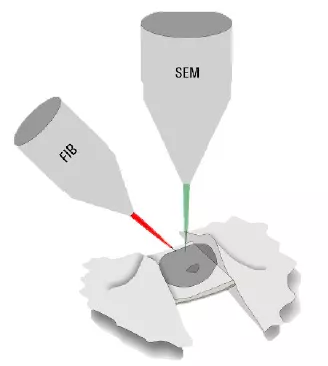
圖3:聚焦離子束研磨技術示意圖。使用掃描電子束觀察樣本的同時,還對樣本專門使用了聚焦離子束(FIB)以去除薄冰片(薄層)上方及下方的物質。
由于整個工作流程較為冗長,所需步驟繁多,而EM上的材料和成像時間又會帶來高昂的成本,因此必須及早確定樣本質量以及網格上存在的靶區。此外還有一大挑戰在于找出精準的研磨位置以確保薄層中含有感興趣蛋白質。
要克服這些挑戰,冷凍光學顯微鏡就成為了整個工作流程當中非常重要的組成部分。使用冷凍光學顯微鏡即可對樣本質量進行檢查,而最為重要的是感興趣結構的位置可以通過使用基因編碼熒光標簽來加以確定(圖4)。
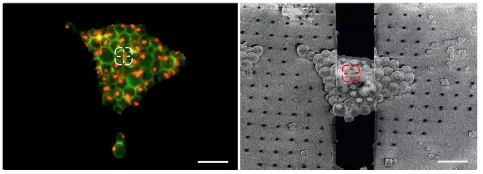
圖4:靶區標定與檢索。冷凍光學顯微鏡和FIB SEM中的熒光酵母細胞。左圖:酵母熒光圖片,其中顯示了紅色的核仁和綠色的細胞壁。用十字光標將核仁標記出來。右圖:在FIB SEM中檢索同樣的位置以便創建出含有感興趣核仁的薄層。此處還顯示了初始研磨階段。薄層(黑色部分)上下研磨窗口可見。比例尺:10µm。感謝Philipp Erdmann博士提供的圖片;酵母莖由德國馬丁雷德Max-Planck生化研究所F. Wil?ing創建。
這些標記可選擇性地查看,并以2D和3D形式揭示出了所有感興趣結構的位置。將熒光圖像和SEM圖像關聯起來就能夠將潛在的研磨部位聯系起來(關聯光學與電子顯微學技術CLEM)。
盡管存在著諸多的挑戰(樣本的安全低溫轉移、冰冷部分可能出現的水冷凝、低溫下對物鏡的使用……),但依然可以使用市售冷凍光學顯微鏡來加以克服。
冷凍光學顯微鏡和去霧處理
徠卡顯微系統提供了專門的冷凍光學顯微鏡 – 冷凍光電聯用系統THUNDER Imager EM Cryo CLEM,其中配備了最新的LED技術和先進的高靈敏度科研CMOS攝像頭(圖5)。
圖5:徠卡顯微系統的專用冷凍光學顯微鏡 – 冷凍光電聯用系統THUNDER Imager EM Cryo CLEM。
按照一個軟件工作流程即可在不到1分鐘的時間里完成整個樣品臺(EM網格)的概覽況圖,并對網格的支撐膜完整性加以檢查。在第二步中則可確定出靶區熒光信號的分布,以及后續FIB研磨的合適區域位置。
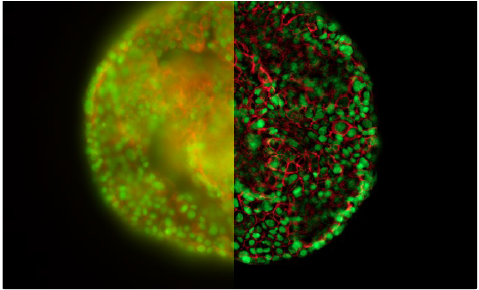
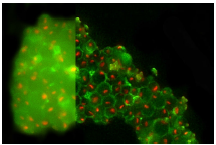
圖6:室溫下THUNDER技術在Hela細胞球體上的應用
不太令人滿意的是,盡管寬場顯微鏡是一種十分靈敏的技術而且非常適合冷凍成像,但圖像中依然可以觀察到背景噪聲。這種主要源于樣本焦點外區域的背景顯著降低了系統的對比度和潛在信噪比(SNR)。所記錄到的圖像通常會顯示一層薄霧,而且可能無法達到正確定位感興趣結構所需的精細水平。
為解決這一寬場問題,徠卡顯微系統開發了全新系列的成像系統 –THUNDER成像儀,利用計算清除技術作為該成像系統的核心技術。每一次對圖像進行采集時會對焦點外背景進行探測并清除,從而實現感興趣信號的直接可用。與此同時,在焦點內區域當中,樣本特征性的邊緣和強度依然得到保留。
尤其對于生物學樣本,其背景在整張圖像內通常無法保持恒定,在視野內的變化較大。計算清除技術可自動解決該問題,從而實現焦點內信號的即刻可見。
THUNDER成像儀提供了三種可選的模式:
即刻計算清除(ICC)
小體積計算清除(SVCC)
大體積計算清除(LVCC)
ICC對應以上所述的計算清除模式。
SVCC和LVCC是計算清除處理與基于決策掩膜的3D去卷積處理的組合,專用于薄層樣本(SVCC)或厚層樣本(LVCC)。去卷積法的自適應圖像信息摘錄遵循的概念是由最初針對共聚焦顯微鏡而研發的徠卡顯微系統自適應去卷積法LIGHTNING所演變而來的。
LIGHTNING使用決策掩膜作為基礎參照來為圖像序列中的各三維像素計算適當的參數設定。結合寬場點擴散函數(PSF)后,LIGHTNING的功能即可轉移用于寬視野探測(更多信息可查看這里)。
THUNDER下的分辨率改善
對單個無重疊衍射限定物體運用小體積計算清除(SVCC)時可使得分辨率增強。在既定示例當中對40 nm直徑的單一珠進行了成像(100x放大透鏡,NA 1.44)并使用了SVCC。相關樣本的結果為分辨率增強*,即橫向增強2倍左右(X切面使用SVCC的比率FWHM/原始數據=0.51)和軸向增強約2.5倍(Z切面使用SVCC的比率FWHM/原始數據= 0.39)。
*由點源發射光的表觀尺寸定義的分辨率增強。低于衍射限值的兩個相鄰結構很難彼此分開。

圖7:尺寸小于光學分辨率限值的單一珠的強度測量。X軸(左)和Z軸(右):SVCC前(藍色點)后(紅色點)。擬合高斯分布(陰影部分)。插圖顯示對應的XY和XZ平面。
由于THUNDER技術成功在環境溫度下進行樣本成像,因此Leica專家隨后提出了在冷凍條件下運用該技術的想法。寬視野冷凍圖像的去霧處理尤為實用,因為這種處理不僅能改善圖像質量,同時還可以確保更加可靠地為后續EM工作流程步驟(即FIB研磨和TEM分析)識別出感興趣結構。
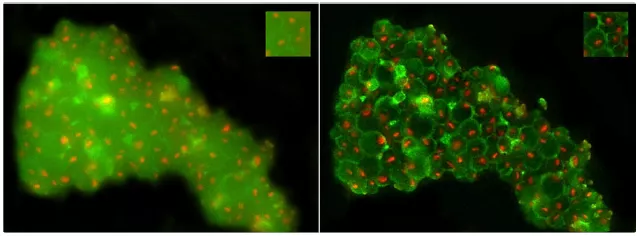
圖8:THUNDER在冷凍條件下的應用。存在核仁標記物NOP56::mars(紅色)表達,并表現出細胞壁顯著自體熒光(綠色)的釀酒酵母細胞。左圖:THUNDER使用前z堆棧的圖像投影;右圖:經THUNDER-LVCC處理后的圖像。插圖顯示了放大區域。比例尺:5µm。感謝Philipp Erdmann博士提供的圖像;莖部分由德國馬丁雷德Max-Planck生化研究所F. Wil?ing創建。
圖8顯示了使用THUNDER技術(THUNDER LVCC)所觀察到的酵母細胞。在左側面板上可以看到,細胞壁綠色自體熒光的焦點外霧化會干擾對核仁的識別。有人可能認為,綠色熒光可以從重疊圖像上移除,但同時還需要對細胞壁進行可視化處理才能識別出核仁并沒有發生粘附。運用THUNDER以后,背景霧化部分有所減少,同時又能將信號保留;細胞壁與核仁清晰可見,而且也更容易滿足FIB研磨的識別目的。
在不同樣本上運用了THUNDER技術。圖9顯示了另一項案例:標記有綠色熒光染料的A9細胞與鬼筆環肽相結合。鬼筆環肽選擇性地與纖維肌動蛋白相結合,在真核細胞當中發揮了結構作用。左圖中的細微結構被焦點外光線(見箭頭處)所隱藏,但在右圖中經過THUNDER SVCC處理后得以顯示。
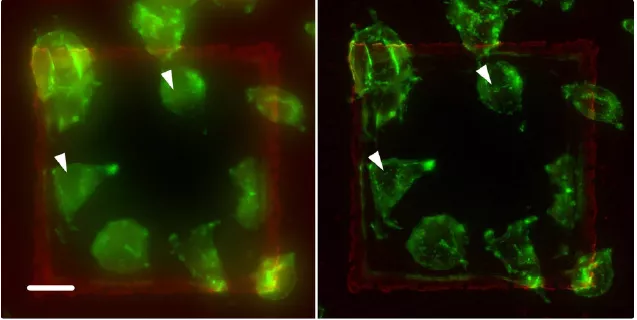
圖9:使用Alexa Fluor 488鬼筆環肽標記纖維肌動蛋白(F肌動蛋白)所標示的A9細胞。THUNDER處理前(左圖)后(右圖)的3D圖像堆棧的投影。THUNDER可清除霧層,甚至最細微的結構(箭頭處)都變得更清晰可見,因此便于完成靶向標定(使用SVCC)。
F肌動蛋白很適合進行THUNDER成像,因為該蛋白屬于薄纖維結構,改善效果能夠立即顯現。連同mCherry 標示的F肌動蛋白,圖10同樣顯示了水泡結構:高爾基體外側網狀結構(TGN)中的蛋白質TGN46通過GFP熒光進行指示。TGN將新的蛋白質指示到不同的亞細胞目標位置。THUNDER技術在移除掉焦點外光線所產生的模糊影像的同時,還顯示了這些小水泡結構。
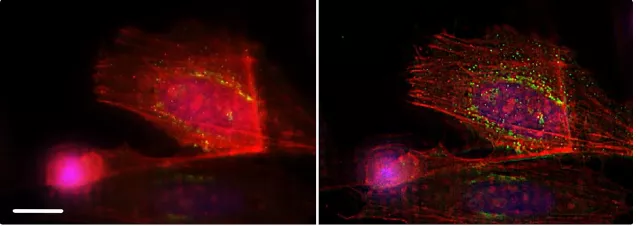
圖10:使用THUNDER SVCC之前(左圖)和之后(右圖)HeLa細胞采用F肌動蛋白染色(mcherry),高爾基體外側網狀結構蛋白TGN46(GFP)以及DNA(Hoechst 33342)。感謝英國倫敦Francis Crick研究所Marie-Charlotte Domart博士和Lucy Collinson博士提供樣本。
總結
在本文中,我們利用計算機清除技術證實了徠卡顯微系統的THUNDER成像技術如何能夠在冷凍狀態下改善玻璃化樣本的圖像質量。即便是細微的結構也能通過去除主要由焦點外光線所形成的霧層或模糊部分來實現可視化觀察。THUNDER成像技術不僅能夠改善圖像質量,同時也有助于更輕松地識別后續EM分析步驟所需要的結構。
相關產品
冷凍光電聯用系統THUNDER Imager EM Cryo CLEM能夠精準識別細胞結構,同時能夠通過關聯工作流程來順暢安全地傳輸坐標、圖像和樣本。
了解更多:徠卡顯微
電話
微信掃一掃
